上海2025年12月17日 /美通社/ — 雲頂新耀(HKEX 1952.HK,以下簡稱「公司」)宣佈,美國食品藥品監督管理局(FDA)已批准LIB Therapeutics旗下心血管疾病領域產品樂瑞泊®(LEROCHOLTM, 通用名: lerodalcibep-liga)注射液的生物製品許可申請(BLA),在飲食控制和運動的基礎上,用於降低成人高膽固醇血症(包括雜合子型家族性高膽固醇血症(HeFH))患者的低密度脂蛋白膽固醇(LDL-C)水平。2025年12月,雲頂新耀與海森生物簽署授權許可協議,獲得了在大中華區開展樂瑞泊®(萊達西貝普,Lerodalcibep)的後續臨床開發、註冊和商業化的獨家許可。
樂瑞泊®是一款新型小分子蛋白結合的第三代PCSK9抑制劑,旨在幫助患者達成並長期維持其 LDL-C 控制目標。作為首個PCSK9抑制劑融合蛋白,樂瑞泊®免疫原性低,安全性出眾。樂瑞泊®經開發為更貼近患者需求、更加便捷,可由患者自行給藥、每月一針、單次小體積皮下注射,並具有較長的室溫穩定性(最長可達3個月),可使患者自行選擇時間和地點用藥,居家旅行皆可方便儲存或攜帶。以上特點使樂瑞泊®成為已獲批的PCSK9抑制劑的獨特替代方案。
在總計超過2,900例患者入組的多項全球大型3期臨床試驗中,結果顯示,樂瑞泊®可使心血管疾病 (CVD) 患者或極高/高風險族群的LDL-C持續降低≥60%,並使LDL-C升幅更嚴重的HeFH患者降低59%。
樂瑞泊®由美國公司LIB Therapeutics研發,有望為全球億萬心血管疾病患者(包括約3,000 萬 HeFH 患者)提供新的治療選擇。心血管疾病仍然是全球及中國的主要死亡原因。研究已證明,降低LDL-C水平可改善患者預後。現有降脂療法下,仍有數百萬心血管疾病患者或高風險人群(包括家族性高膽固醇血症)未能達到最新指南推薦的 LDL-C 控制目標。中國血脂異常人群規模約4億,接受降脂治療的比例僅約14%,反映出滲透率偏低及顯著的未滿足醫療需求。PCSK9 抑制劑在降低 LDL-C 水平方面顯示出優良的療效與安全性。
樂瑞泊®在中國用於治療高膽固醇血症(包括HeFH)患者的關鍵註冊性3期臨床試驗,目前已完成為期12周的隨機、雙盲、安慰劑對照治療階段的數據分析,已達到第12周 LDL-C 降低的主要療效終點,並達到其他致動脈粥樣硬化脂質及載脂蛋白改善的次要療效終點,與安慰劑相比顯示出良好的安全性和耐受性特徵。
目前中國已有多款PCSK9抑制劑獲批上市,2024年總市場規模約人民幣30億元,同比增長95%。根據弗若斯特沙利文 (Frost & Sullivan) 報告,預計該市場將於2030年進一步擴大至約人民幣100億元。樂瑞泊®在中國的專利獨佔期至2039年。
目前,該產品也已向歐洲藥品管理局 (EMA) 遞交上市申請,並預計將在2026年上半年於大中華區遞交生物製品上市申請 (BLA),最快有望於2027年獲得批准並上市。
關於樂瑞泊®(萊達西貝普, Lerodalcibep)
樂瑞泊®是一款新型小分子蛋白結合的第三代PCSK9抑制劑,旨在幫助患者達成並長期維持其 LDL-C 控制目標。作為PCSK9抑制劑融合蛋白,樂瑞泊®免疫原性低,安全性出眾。樂瑞泊®經開發為更貼近患者需求、更加便捷,可由患者自行給藥、每月一針、單次小體積皮下注射,並具有較長的室溫穩定性(最長可達 3 個月),可使患者自行選擇時間和地點用藥,居家旅行皆可方便儲存或攜帶。以上特點使樂瑞泊®成為已獲批的PCSK9抑制劑的獨特替代方案。樂瑞泊®的抗PCSK9結合域是一個分子量僅為11kDa稱為adnectin的多肽,能與人類的PCSK9高度親和,其親和力達到亞納摩爾級,並且與人血清白蛋白融合,以延長血漿半衰期。
關於雲頂新耀
雲頂新耀是一家專注於創新藥和疫苗研發、臨床開發、製造和商業化的生物製藥公司,致力於滿足全球市場尚未滿足的醫療需求。雲頂新耀的管理團隊在中國及全球領先製藥企業從事過高質量研發、臨床開發、藥政事務、化學製造與控制(CMC)、業務發展和商業化運營,擁有深厚的專長和豐富的經驗。雲頂新耀已打造多款全球同類首創和同類最佳的藥物組合,公司的治療領域包括腎科、自身免疫、急重症、心血管及眼科等。有關更多信息,請訪問公司網站:www.everestmedicines.com。
關於LIB Therapeutics Inc.
LIB Therapeutics 是一家處於商業化階段的私人控股生物製藥公司,致力於開發並提供創新、高效且安全的治療方案,幫助數以百萬計的心血管疾病及家族性高膽固醇血症患者實現其低密度脂蛋白膽固醇(LDL-C)控制目標。欲瞭解更多信息,請訪問:www.libtherapeutics.com。
前瞻性聲明
本新聞稿所發佈的信息中可能會包含某些前瞻性表述,乃基於本公司或管理層在做出表述時對公司業務運營情況及財務狀況的現有看法、相信、和現有預期,可能會使用「將」、「預期」、「預測」、「期望」、「打算」、「計劃」、「相信」、「預估」、「確信」及其他類似詞語進行表述。這些前瞻性表述並非對未來業績的保證,會受到風險、不確定性及其他因素的影響,有些乃超出本公司的控制範圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展等各種因素及假設的影響,實際結果可能會與前瞻性表述所含資料有較大差別。本公司及各附屬公司、各位董事、管理人員、顧問及代理未曾且概不承擔更新該稿件所載前瞻性表述以反映在本新聞稿發佈日後最新信息、未來項目或情形的任何義務,除非法律要求。


西班牙巴塞羅那2026年3月3日 /美通社/ — 全球領先的移動數據流量共享市場公司-優克聯(uCloudlink Group Inc., NASDAQ: UCL)今日在2026年世界移動通信大會(MWC 2026)上發佈了戰略路線圖 。優克聯聚焦於利用其獨特的端側解決方案,從B2B/B2B2C/B2C等多行業維度,優勢挖掘重大市場機遇,依托自主研發的 CloudSIM® 和 AI HyperConn® 技術,賦能合作夥伴以零基建成本擴展全球網絡,並在三大數字前沿領域捕獲增量利潤 。 優克聯以四大科技基座,開啟智聯全球、萬物互聯與寵物科技的千億藍海 為實現這一願景,優克聯正致力於通過彌合三大關鍵鴻溝來創造全新的商業藍海 : 打通「跨國與跨網」的阻隔:將跨國跨網連接阻礙轉化為無感漫遊 。 連接「萬物與萬網」的孤島:將孤立的IoT終端連接成無縫的全球網絡 。 跨越 「人類與物種」的邊界:縮小人類與寵物之間的情感與數字鴻溝 。 三大戰略增長引擎 1. 全球連接的顛覆者:eSIM Trio 針對全球40億部存量物理SIM卡手機市場,優克聯推出了行業首款「全球超級黑卡」—— eSIM Trio 。 商業驗證:近期與某大型移動網絡運營商(MNO)合作開展的成功試點,為聯合制卡與現網放號奠定了堅實基礎 。 夥伴價值:通過賦予存量手機eSIM能力,該方案為移動虛擬運營商(MVNO)提供了最便捷、低成本的全球擴張路徑,助力運營商提升用戶等級並降低離網率 。 2. 科技共情力的前沿:petpogo 生態系統 依托 3200億美元 的全球寵物市場,優克聯發佈了專為AI時代寵物設計的數字生態系統 petpogo 。 創新首秀:該生態系統包含智能穿戴設備 PetPhone,以及在歐洲首發的 PetCam(一款沉浸式1080P寵物第一視角攝像頭) 。 營收新渠道:該領域賦能運營商從基礎流量套餐向高毛利的訂閱服務轉型,為數百萬家庭提供主動關懷與AI增強的情感連接 。 3. IoT 指數級增長:運營+算法 優克聯致力於實現IoT領域的突破,利用專利技術助力合作夥伴擴展服務並簡化流程 。 規模化擴張:隨著IoT用戶採用率實現超過10倍的年增長,「統一平台、統一結算」模式使製造商能夠從銷售「硬件」轉型為運營「全球服務」 。 行業領先的精準度:依托 AI HyperConn®,優克聯在390多家運營商網絡中實現對數百萬台設備(從行車記錄儀到CarPlay中心)的毫秒級精準管理 。 加速「流動中的商業」生活方式 優克聯繼續在MBB和LIFE領域保持領先地位,其旗艦方案包括 : MeowGo G50 Max:集成衛星、機上Wi-Fi及地面網絡的AI連接中心,提供「零掉線」體驗 。 OmniFlex Pro:專為快速增長的房車市場和數字遊民打造的Wi-Fi 7「常時在線」守護者 。 「隱形 Wi-Fi」 (LIFE):通過 UniCord Pro(充電線)和 RoamPlug(旅行轉換插頭),將連接能力直接嵌入日常硬件,重新定義出行必備工具 。 關於優克聯 (uCloudlink Group Inc., NASDAQ: UCL) : 優克聯是全球首家且領先的移動數據流量共享市場,為全球 200 多個國家和地區的用戶提供更優質的移動數據連接服務。通過其自主研發的 CloudSIM® 和 AI HyperConn® 技術,優克聯賦予用戶和企業隨時隨地連接至最佳可用網絡的能力 。 優克聯亮相 MWC 2026 首日,斬獲 8 項重磅大獎 科技共情力的前沿創新首秀:petpogo 生態系統 優克聯主題演講:三大賽道掘金千億藍海,智聯全球、萬物互聯與寵物科技 消息來源: uCloudlink Group Inc.




阿聯酋迪拜2026年2月27日 /美通社/ — 隨著加密恐懼與貪婪指數跌至歷史低位,比特幣亦從高點大幅回調,全球交易量第二大加密貨幣交易所 Bybit 重申一個樸素信念:在市場不確定性加劇的時刻,社區最需要的是穩定、清晰的指引,以及獲取穩健收益的真實機會。 面對波動,Bybit 選擇迎難而上——拓展新機遇、強化類固收產品體系,與全球使用者並肩同行。 「我們相信,當下使用者最需要的就是穩定性,」Bybit 聯合首席執行官 Helen Liu 表示。「市場終將復甦,對此我們毫無疑問。 但在此過程中,我們的職責是説明用戶緩解壓力,提供獲取穩定收益的切實途徑,並確保社區始終知曉:Bybit 始終與他們站在一起。」 關鍵時刻,穩定為先 穿越多輪市場週期,Bybit 深知市場情緒轉變之迅疾,也理解波動對普通投資者的深遠影響。 當前,公司正加速佈局穩定幣收益機會與資本效率工具,助力使用者在不確定時期保值增值、獲取可預期回報。 Helen 表示:「我們希望為使用者挖掘每一個獲取穩健收益的機會。 無論是通過 Mantle Vault 獲取鏈上收益,還是藉助 BYUSDT 提升資本效率,目標始終一致——讓每一美元發揮更大價值,幫助社區更從容、更自信地度過當前階段。」 Bybit 認為,當前市場也正反映出投資者行為的深層結構性變化: 「這一輪周期與眾不同。 使用者不再盲目追逐百倍回報,而是更注重本金保護與可持續收益。 這種轉變是結構性的,而非情緒驅動的。」 與社區攜手同行 Bybit 將推出總額高達 1,000 萬美元的穩定幣支援類固收產品,為使用者在波動市場中提供更多獲取可預期回報的途徑。 「Bybit 將於 3 月陸續上線穩定幣賺幣產品,服務全球社區。 我們致力於行業的長期發展,」Helen 補充道。「我們始終堅信支持社區的重要性——無論牛市還是熊市。 我們支援穩定幣生態,是希望緩解使用者在特殊時期面臨的個人壓力;我們投入企業社會責任(CSR)與生態建設,是因為健康的行業生態惠及所有人。 我們將持續踐行這一理念,因為這是 Bybit 的初心與本色。」 Bybit 深信,不確定時刻恰恰是檢驗行業成色的試金石。 公司團隊保持全天候協同,與合作夥伴及使用者保持開放溝通,堅持透明優先,並快速響應,確保社區始終資訊同步、信心堅定。 請在社交媒體上關注#Bybit / #TheCryptoArk。 關於Bybit Bybit是全球交易量第二大加密貨幣交易所,服務超過8000萬全球用戶。Bybit成立於2018年,致力於為大眾打造一個更簡單、開放和平等的生態系統,從而在去中心化的世界中重新定義開放性。Bybit深耕Web3領域,與領先的區塊鏈協議進行戰略合作,提供堅實的基礎設施並推動鏈上創新。Bybit憑借安全的托管服務、多元化的市場、直觀的用戶體驗和先進的區塊鏈工具而聞名,搭建了傳統金融(TradFi)與去中心化金融(DeFi)之間的橋樑,賦能建設者、創造者和愛好者充分挖掘Web3的全部潛力。探索去中心化金融的未來,請訪問Bybit.com。 更多信息請訪問Bybit Press媒體垂詢,請聯繫:media@bybit.com如需瞭解最新信息,請關注Bybit社群和社交媒體 Discord | Facebook | Instagram | LinkedIn | Reddit | Telegram | TikTok | X | Youtube



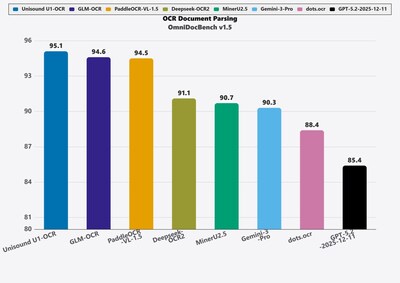
北京2026年2月26日 /美通社/ — 就在剛剛,雲知聲正式推出「Unisound U1-OCR」 文檔智能基礎大模型。作為首個工業級文檔智能基座,該模型憑借 「性能 SOTA、可信可驗、開箱即用、高效部署、強適配」 五大核心優勢,打破傳統文檔處理邊界,樹立起行業新標杆。 一、技術跨越:從 OCR 2.0 邁向 3.0 文檔智能(Document Intelligence)是指利用人工智能技術自動閱讀和理解文檔影像,並進行內容的讀取、理解、分類及關鍵信息提取。傳統視覺方案(OCR 1.0,以 CRNN 為代表)僅能識別文字,新一代多模態方案(OCR 2.0,以VLM為代表 )具備初步版面理解能力。而 「Unisound U1-OCR」 則正式開啟 OCR 3.0 時代——在理解版面的基礎上,進一步洞察文檔深層語義,實現自動分類與業務級信息抽取,完成了從「字符感知」到「文檔認知」的質的飛躍。 二、實力領跑:多項權威評測穩居全球第一梯隊 「Unisound U1-OCR」是一款達到國際頂尖水平(SOTA)的文檔智能理解模型,其核心優勢在於突破了傳統模型「只讀文字、不懂排版」的瓶頸,能夠像人類專家一樣「看懂」複雜文檔。為適應 OCR 3.0 時代對於文檔業務級結構化抽取的新要求,Unisound U1-OCR 采用 ViT + LLM 架構,其中視覺編碼器部分采用 NaViT 架構,實現文檔分辨率動態處理,模型參數規模 3B 量級,兼顧模型計算效率與文檔深層語義信息理解的能力要求。除此之外,模型還提出了多項創新舉措: 首先,它擁有「先懂結構,再讀內容」的智慧。傳統模型往往按順序死板閱讀,而「Unisound U1-OCR」首創了「語義驅動+動態聚焦」策略。如同人類閱讀習慣,先梳理文檔目錄、標題的層級關系,再按需提取內容。模型能自動構建文檔的「語義地圖」,精准識別標題、圖表與正文的從屬關系,即使面對排版混亂的極端場景,也能條理清晰地提取信息。 其次,它具備敏銳的「空間感知力」。通過強化空間對齊模塊,模型能充分利用文字在頁面上的位置信息,主動理解元素間的空間布局。結合動態分辨率技術,無論是密集表格還是圖文混排,它都能精准還原文檔結構,徹底解決了以往模型「張冠李戴」的空間盲區。 此外,模型采用Multi-Token Prediction(MTP)技術——在預測當前 Token時,同步考慮未來多個Token的概率分布,大幅提升長文檔邏輯連貫性。配合全任務強化學習策略,增強模型對版式結構的全局預見性並在推理階段將模型生成效率提升了80%以上。在訓練階段,采用多任務協同強化訓練方案,實現文檔結構還原、文檔分類與信息抽取的深度對齊。強化訓練策略圍繞「語義+坐標」雙目標優化,針對坐標回溯的 IoU 精度進行專項強化,有效遏制定位幻覺,確保輸出結果的物理可信度。通過多檔位分辨率擾動與Mask采樣策略,顯著提升了模型多場景文檔圖像的理解能力。 憑借這些創新,Unisound U1-OCR在多項權威測試中均獲業界SOTA表現,真正實現了從「識別文字」到「理解文檔」的跨越。 1. OmniDocBench V1.5評測SOTA 在OmniDocBench V1.5評測中,Unisound U1-OCR以95.1分取得SOTA表現(如圖1),領先GLM-OCR,Deepseek-OCR2,Gemini-3-Pro,GPT-5.2等主流模型,實現了精度與泛化能力的雙重突破。 圖1Unisound U1-OCR在OmniDocBench V1.5的評測得分對比 2. D4LA評測SOTA 在D4LA評測中, F1 分數達 90.8,大幅領先 DocLayout-YOLO(87.3)、PP-StructureV3(86.0)。無需微調即可高精度解析學術論文、財務報表等 11 類高複雜度文檔。 3. DocLayNet評測SOTA 在DocLayNet評測中,F1 分數 95.9,超越 MinerU 2.5、PP-StructureV3 等模型。在表格識別、跨頁關聯、微小文本檢測等高難任務上優勢顯著,魯棒性極強。 4. 業務相關評測SOTA 在內部業務測試中,其信息抽取與文書分類能力超越 Gemini-2.5-Flash、Qwen-235B-VL 等主流通用商業和開源模型。特別是在醫療入院記錄、出院小結等強業務場景中,領先優勢尤為明顯,Unisound U1-OCR 以 3B 規模的參數獲得比更大規模通用 VLM 更好的評測性能。與較小尺寸的文檔解析任務模型相比,得益於模型多項創新舉措,在業務級信息抽取等深層語義信息理解的能力表現更好。 三、面向真實場景:4大核心能力助推U1-OCR從「讀懂」邁向「執行」 作為開 啟OCR 3.0時代的文檔智能基礎大模型,除了在通用評測中斬獲多項SOTA,Unisound U1-OCR更立足工業級場景需求,打造了四大核心能力,實現從『讀懂』到『執行』的業務落地。 1. 可信可查:精准溯源,結果可驗 模型獨創「坐標-文本-語義」融合架構,實現像素級精准定位與完整證據鏈構建。在完成信息抽取的同時,系統精准標示信息在文檔中的來源位置,使結果審核過程全透明、可追溯,從技術層面保障文檔處理結果的可信度,徹底解決傳統文檔處理「結果不可驗」的行業難題。 例如,在企業審核場景中,審核人員無需大海撈針般翻閱原文,點擊抽取結果即可實時高亮定位原始位置。這種「人機協同」的閉環將審核耗時縮短至秒級,讓人工漏檢率降至最低,真正實現了「可信任的AI」。 2. 業務融合:開箱即用,Agent Ready 通用OCR工具在專業領域存在局限——例如醫保結算單中「自付一」「自付二」與「個人自費」的邏輯關系,或合同中金額大小寫的校驗規則,都需要領域知識支撐。 Unisound U1-OCR在基礎模型之上,融入了雲知聲在醫療、金融等領域的行業知識積累,模型可基於業務邏輯進行多字段關聯校驗。在內部業務測試中,面向50餘種常見業務文書的分類准確率超過99%。 3. 高效部署,安全可控 模型深度支持私有化與離線部署,可在無外網環境下穩定運行,完美匹配政務、醫療、金融等高安全等級行業的數據隱私保護需求。同時,通過版面級並行解碼與多Token預測架構等優化措施,一份十多頁的文檔,整理處理可在數秒內完成,高效的文檔處理能力,讓工業級文檔智能能力觸手可及。 4. 超強適配,攻克複雜場景 針對企業實際業務中遇到的非標准拍照、文檔彎折模糊、複雜花式排版、多語言混排等各類極端複雜文檔場景,Unisound U1-OCR仍能保持穩定、高精度的處理表現,徹底擺脫傳統技術對標准化文檔的依賴,真正適配企業真實業務的全場景需求。


